| 第3編 無機物質
第2章 金属元素(Ⅰ)ー典型元素ー
|
|
1アルカリ金属
2マグネシウムとアルカリ土類金属
3アルミニウム,亜鉛,スズ,鉛
|
|
|
1 アルカリ金属元素(1族元素)h
周期表の1族にはH,Li,Na,K,Rb,Cs,Frが含まれる。水素H以外の元素はアルカリ金属と呼ばれる。
【アルカリ金属の単体】 |
|
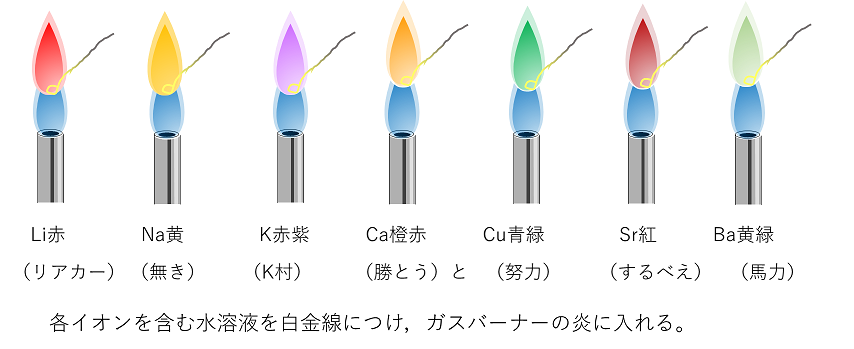
アルカリ金属は密度が小さく,軟らかく,融点の低い金属である。価電子数が〔 1 〕(最外殻電子数が1個)なので,1価の〔 陽 〕イオンになりやすい。そのため,反応性が大きく,色々なものと反応する。例えば,水とは激しく反応して〔 水素 〕を発生する①。そのためアルカリ金属の単体は〔 石油 〕中で保存する。同じアルカリ金属内では,より外側の電子殻を最外殻とするものが,より大きな反応性を示す②。また,アルカリ金属やアルカリ土類金属および銅のイオンを炎の中に入れると,炎の色が元素特有の色になる。これを〔 炎色反応 〕③という。
ナトリウムの単体は工業的に塩化ナトリウムの〔 溶融塩電解 〕④により製造される。
|
|
|
① 〔 2Na + 2H2O → 2NaOH + H2 〕(無機化学の反応式 パターン1 金属と水 ⇒ その金属の水酸化物+α)
② 外側の電子殻にある電子は,原子核から離れているので,内側の電子殻にある電子よりも原子核の支配を受けない。反応は最外殻の電子のやり取りによって起こるので,アルカリ金属内ではより最外殻が外側にあるFrが最も反応性が大きくなる。
③ 炎の中に入れるとイオンは高エネルギーの状態になる。それが元の状態に戻るときに余ったエネルギーを光として放出する。それぞれの炎色反応の色は覚えておく。
|
 |
|
④ 塩に熱を加え融解させた状態で白金Pt電極で電気分解する。
陽極〔 2Cl- → Cl2 + 2e- 〕 陰極 〔 Na+ + e- → Na 〕
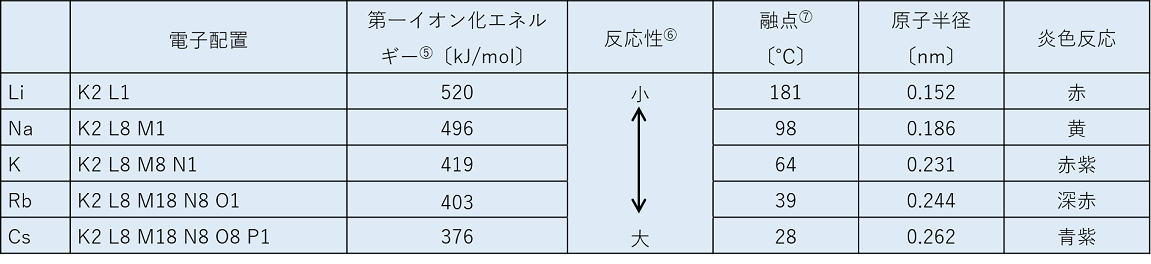
アルカリ金属の電子配置と性質
|
 |
|
⑤ 原子から電子を〔 1つ取り去って 〕,1価の〔 陽イオン 〕にするのに必要なエネルギーをいう。陽性の強い原子(同族では原子番号が大きいほど強い)ほど電子を〔 放出 〕しやすいので,イオン化エネルギーは〔 小さく 〕なる。つまり周期表上では〔 右上 〕にあるものほど大きくなる。
⑥ イオンになりやすい原子(陽性が大きい,イオン化エネルギーが小さい)の方が反応しやすいので,アルカリ金属内では周期表で下に行くほど反応性が大きくなる。
⑦ 金属の原子どうしは〔 金属結合 〕によって結合している。この結合では,原子が〔 価電子 〕を放出し,〔 陽イオン 〕となる。このとき放出された電子は陽イオン間を自由に動き,陽イオンどうしを結びつけている。この電子を〔 自由電子 〕という。アルカリ金属では最外殻の1個の電子が自由電子となる。アルカリ金属の原子半径は,Li<Na<K<・・・なので,つぎのように自由電子による結合力はLi>Na>K>・・・となる。融点は粒子の結合力が大きいほど高くなるので,融点はLi>Na>K>・・・となる。
|
 |
|
【アルカリ金属の化合物①(水酸化ナトリウムNaOH)】
|
|
アルカリ金属の水酸化物の水溶液は強い〔 塩基 〕性を示す。ナトリウムの水酸化物である水酸化ナトリウムNaOHは半透明の固体である。NaOHは水分をよく吸収するので,空気中に放置しておくと,空気中の水分をも吸収して,その水分で自らが溶けてしまう。この性質を〔 潮解 〕性という。NaOHは固体でも水溶液でも〔 二酸化炭素 〕をよく吸収し,〔 炭酸ナトリウム 〕をつくる①。
水酸化ナトリウムは,工業的に塩化ナトリウム水溶液の電気分解②により製造される。
|
|
|
① 〔 2NaOH + CO2 → Na2CO3 + H2O 〕(無機化学の反応式 パターン2 金属とCO2 ⇒ その金属の炭酸塩+α)
② NaCl水溶液の電気分解(炭素C電極)
陽極 〔 2Cl- → Cl2 + 2e- 〕 陰極 〔 2H2O + 2e- → H2 + 2OH- 〕
溶液中には,残ったNa+と生成したOH-でNaOHができる。
|
【アルカリ金属の化合物②(炭酸ナトリウムNa2CO3)】 |
|
アルカリ金属の炭酸塩や炭酸水素塩はNaOHなどのアルカリ金属の水酸化物と炭酸H2CO3(二酸化炭素CO2の水溶液)の中和によって生成する塩で,強塩基と弱酸の塩なので,アルカリ金属の炭酸塩や炭酸水素塩の水溶液は〔 塩基性 〕を示す。
ナトリウムの炭酸塩であるNa2CO3は通常,結晶中にH2O10分子を含んでいて, Na2CO3・10H2Oで示される。この水を〔 水和水 〕という。水和水は加熱などにより,結晶中から抜けるが,Na2CO3・10H2Oは空気中に放置すると,自然に水和水が抜けてNa2CO3・H2Oとなり,結晶が崩れて粉末となる。この性質を〔 風解 〕性という。アルカリ金属の炭酸塩は安定で,加熱しても分解せず融解する。炭酸塩に対して,炭酸水素塩は加熱すると分解して〔 二酸化炭素 〕を発生し〔 炭酸 〕塩になる①。炭酸水素ナトリウムは加熱によってCO2が発生するので,調理でベーキングパウダーに使われる。また炭酸ナトリウムは〔 アンモニアソーダ法 〕によって工業的に製造される②。
|
|
|
① 〔 2NaHCO3 → Na2CO3 + CO2 + H2O 〕(無機化学の反応式 パターン8 炭酸水素塩の加熱 ⇒ 炭酸塩+CO2+H2O)
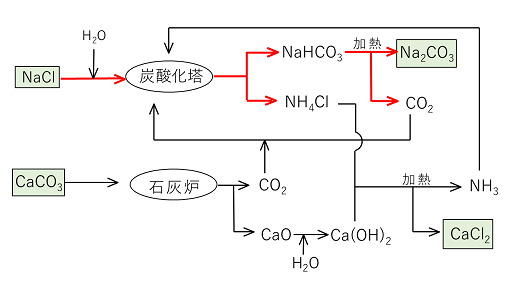
② アンモニアソーダ法(またはソルベー 法)
原理
1)塩化ナトリウムの飽和水溶液にアンモニアと二酸化炭素を通じると,比較的溶解度の小さい〔 炭酸水素ナトリウム 〕が沈殿する。
|
|
〔 NaCl +
NH3 + CO2 +
H2O → NaHCO3 +
NH4Cl 〕・・・ⅰ)
(特殊な反応式なので覚える)
2)この沈殿を集めて焼くと,炭酸ナトリウムが得られる。
〔 2 NaHCO3 → Na2CO3 + CO2 + H2O 〕・・・ⅱ)
(無機化学の反応式 パターン8 炭酸水素塩の加熱 ⇒ 炭酸塩+CO2+H2O)
|
 |
|
|
再利用の過程
ⅱ)式の反応で生じたCO2は再びⅰ)式の反応に利用されるが,不足するときは石灰石CaCO3を焼いて作られる。
〔 CaCO3 → CaO + CO2 〕・・・ⅲ)(無機化学の反応式 パターン7 炭酸塩の加熱 ⇒ 酸化物+CO2)
ⅰ)の反応で生じた塩化アンモニウムNH4Clはⅲ)式で生じる酸化カルシウムから作った水酸化カルシウムと反応させてアンモニアを回収し,再びⅰ)式の反応に利用する。
〔 CaO + H2O → Ca(OH)2 〕・・・ⅳ)(無機化学の反応式 パターン1 金属と水 ⇒ その金属の水酸化物+α)
〔 2NH4Cl + Ca(OH)2 → CaCl2 + 2H2O + 2NH3 〕・・・ⅴ)
(無機化学の反応式 パターン9 弱塩基の塩と強塩基 ⇒ 弱塩基と強塩基の塩)
|
 |